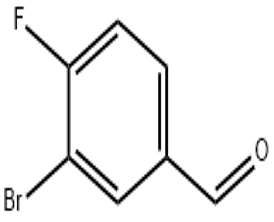
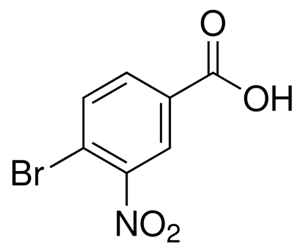
alfa-jonon(CAS#127-41-3)
| Riskkoder | R42/43 – Kan ge allergi vid inandning och hudkontakt. |
| Säkerhetsbeskrivning | S24/25 – Undvik kontakt med hud och ögon. |
| WGK Tyskland | 2 |
| RTECS | EN0525000 |
| TSCA | Ja |
| HS-kod | 29142300 |
alfa-jonon(CAS#127-41-3) information
Violett keton, även känd som bensofenon, är en organisk förening. Här är lite säkerhetsinformation om ionone:
1. Toxicitet: Violett keton har viss toxicitet för människokroppen. Det kan orsaka skador på det centrala nervsystemet och levern och kan ha negativa effekter på reproduktionssystemet och embryon.
2. Inandningsrisk: Inandning av ånga eller damm från jonon kan orsaka obehagssymptom som yrsel, dåsighet, hosta och andningssvårigheter. Långvarig exponering kan orsaka skador på det centrala nervsystemet.
3. Kontaktrisk: Violett keton kan absorberas genom huden. Långvarig eller omfattande kontakt kan orsaka hud- och ögonirritation. Lämplig personlig skyddsutrustning såsom handskar och skyddsglasögon bör bäras vid hantering av jonon.
4. Brandsläckningsåtgärder: Vid läckage eller brand, använd torrt pulver, skum eller koldioxid för att släcka branden. Undvik att använda vatten, eftersom violett keton reagerar med vatten och producerar brandfarliga gaser.
5. Avfallshantering: Kassera avfall från violett keton på rätt sätt i enlighet med lokala föreskrifter och regler. Släpp inte ut det i avloppet eller soptunnan.
6. Försiktighetsåtgärder vid förvaring: Violett keton ska förvaras på en sval, torr, väl ventilerad plats, borta från brandkällor och oxidanter.
Denna information är endast för referens. Om ytterligare användning eller bearbetning av jonon krävs, vänligen se det relevanta säkerhetsdatabladet och kontakta en fackman.
natur
Violett keton, även känd som linaylketon, är en naturlig ketonförening. Det är huvudkomponenten i aromen av violetta blommor.
Violett keton är en färglös till blekgul oljig vätska som är flyktig vid rumstemperatur.
Violett keton är lösligt i alkohol och eterlösningsmedel och svagt lösligt i vatten. Dess densitet är relativt låg, med en densitet på 0,87 g/cm³. Den är känslig för ljus och kan absorbera ultravioletta strålar.
Violett keton kan oxideras till ketonalkoholer eller syror i kemiska reaktioner, och kan reduceras till alkoholer genom hydreringsreduktionsreaktioner. Det kan genomgå alkylerings- och förestringsreaktioner med många föreningar.
Applicerings- och syntesmetod
Violett keton (även känd som lila keton) är en aromatisk ketonförening. Den har speciell doft och används ofta i parfym- och parfymindustrin. Följande är en introduktion till användningen och syntesmetoderna för ionon:
Ändamål:
Parfym och krydda: doftegenskaperna hos ionon, som används flitigt i parfym- och kryddindustrin för att tillverka violdoftprodukter.
Syntesmetod:
Syntesen av jonon uppnås i allmänhet genom följande två metoder:
Oxidation av nukleobensen: Nukleobensen (en bensenring med en metylsubstituent) utsätts för en oxidationsreaktion, såsom att använda en oxiderande syra eller en sur kaliumpermanganatlösning, för att generera jonon.
Koppling av pyrylbensaldehyd: pyrylbensaldehyd (såsom bensaldehyd med pyridinringsubstituenter i para- eller metapositionen) reageras med ättiksyraanhydrid och andra reaktanter under alkaliska betingelser för att bilda jonon.